Info Tekno dan Hiburan Terbaru
Info seputar gadget, tekno, games, lifestyle, dan hiburan lainnya yang menarik, kami sajikan dengan ringkas untuk anda.
Artikel Terbaru

Review e-Padi; Hosting Senior Di Indonesia
Di Indonesia sudah banyak jasa layanan hosting yang bisa dikatakan cukup murah dan berkualitas. Ada …

Review Dhyhost Terbaru
Dyhost merupakan salah satu solusi Web Hosting di Indonesia. Jasa yang ditawarkan yaitu berupa registrasi …

Review Realme 3, Harga beserta Spesifikasi Terkini
Jika Anda ingin melihat ulasan lengkap dari fitur dan spesifikasi Realme 3 dan jika Anda …

Review Realme 3 Pro, Harga dan Spesifikasi Terbaru
Realme 3 Pro merupakan smartphone terbaru dari Realme yang ditargetkan tidak hanya kaum muda tetapi …
Review Unlimited Hosting Terbaik
Bisa dikatakan hosting unlimited memiliki keuntungan tersendiri terutama bagi para pemilik web yang hendak mengoptimalkan …
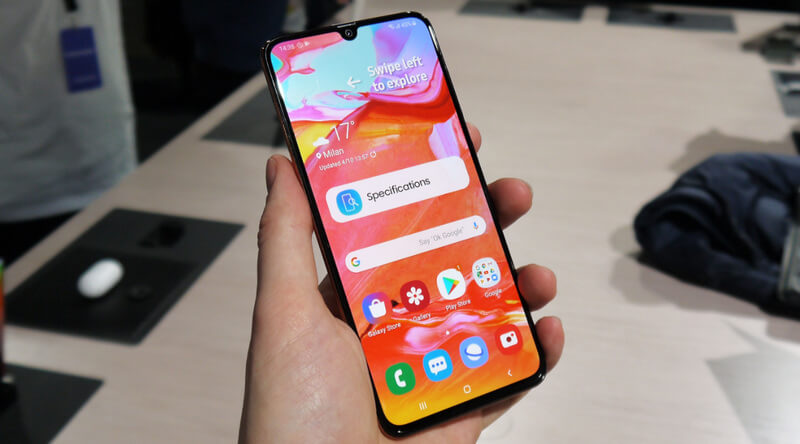
Samsung Galaxy A70, Spesifikasi Dan Harga Terbaru
Samsung telah membuat peningkatan yang pada seri Galaxy A. Pada Seri A, Samsung telah memiliki …
Pilihan Reseller Hosting Terbaik
Reseller hosting adalah program supaya para reseller bisa menjual kembali web hosting tanpa mengeluarkan modal …
Review Liquid Web Terbaru
Liquid web adalah penyedia hosting yang digunakan untuk pengguna web dan cloud yang telah profesional. …
Review KnownHost Terbaru
Penyedia hosting KnownHost, telah didirikan sejak tahun 2006 lalu. Perusahaan web hosting milik pribadi ini …
Review Jetdino Terbaru
Salah satu provider web hosting yang memberikan berbagai layanan kepada masyarakat adalah Jetdino. Jetdino memiliki …

Review Dewabiz ; Paket Hosting, Harga, dan Lainnya Lengkap
Salah satu pemain hosting yang turut meramaikan industri perhostingan khususnya di Indonesia yaitu Dewabiz. Dewabiz …
Review Masterweb Terbaru
Untuk memperluas jaringan bisnis Anda, salah satu upaya yang dapat dilakukan dan terbukti efektif adalah …
Review Dapur Hosting Terbaru
Ada banyak provider web hosting di Indonesia, salah satunya yaitu Dapur Hosting. Dapur Hosting adalah …
Review Indowebsite; Hosting Senior Di Indonesia
Mengelola sebuah website ternyata tidak mudah. Untuk mengatasinya, web hosting memberikan layanan bagi pemilik website …
Review Ardhosting Terbaru
Perkembangan teknologi di seluruh dunia semakin pesat. Salah satu implementasi penggunaan teknologi komputer maupun internet …
